Mesoblast的啟示:中國干細胞企業能否迎風而上?
2024年12月18日,美國食品藥品監督管理局(FDA)正式批準了Mesoblast公司骨髓來源的間充質干細胞(MSCs)產品Ryoncil(remestemcel-L-rknd),用于治療2個月及以上兒科患者的類固醇難治性急性移植物抗宿主病(SR-aGVHD)。這一消息鼓舞了整個干細胞行業的士氣,打破了干細胞不能成藥的謠言。
干細胞藥物是超脫于小分子藥物之外的一類新的藥物,產品復雜而且有多種活性,其成藥之路存在著諸多困難和不確定性。2013年,Mesoblast(2004年成立)從Osiris(1992年成立)手中接過remestemcel的接力棒,并孤注一擲將其推向上市,用了將近12年的時間。如果疊加Osiris在加拿大和新西蘭市場的努力,骨髓間充質干細胞藥物拿到美國FDA的認可,至少花費了20年的時間。

拓寬視野 沿著成功者的軌跡堅定不移
不同于現有藥物比較成熟的成藥性評價體系,MSCs由于其動態變化性、作用復雜性、體內監測難等特點導致其藥效可預測性低,作用機制不明確。因此,在MSCs的成藥性研究中,如何解決體外效價指標與臨床療效相關性差、藥動學數據無法解釋藥效作用機制等問題,是橫亙在產品上市前的重要難題。
實際上,Mesoblast同樣在這方面屢次碰壁。Mesoblast前2次向FDA提交的臨床上市申請,都被FDA否決了。FDA在回復中反復提及效力測定和藥學的問題。盡管Mesoblast準備了詳細且具有說服力的臨床試驗數據(這些研究主要有275研究、GVHD 001/002研究和280研究,涵蓋多個國家和地區的500多例患者),并且取得了非常不錯的臨床效果。
Mesoblast此前提出的干細胞作用機制(Mechanism of Action,MOA)是,干細胞通過下調促炎細胞因子、增加抗炎細胞因子,將自然產生的抗炎細胞招募到相關組織中,來對抗與多種疾病相關的炎癥過程。
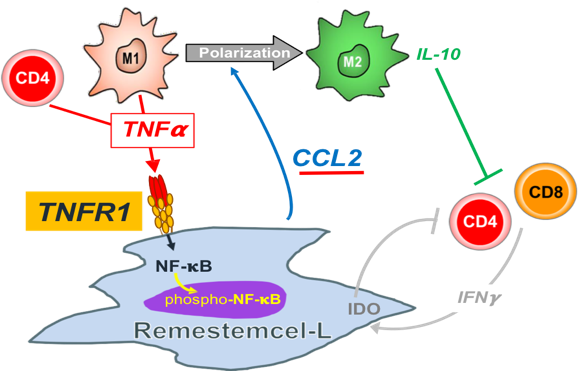
MSC通過TNF-α介導活化NF-kB而發揮免疫抑制作用,并通過siRNA干擾技術驗證了降低或敲除TNFR1會降低MSC的淋巴細胞抑制能力,不同表達水平的TNFR1與細胞的淋巴細胞抑制能力成一定的相關性。因此,Mesoblast將TNFR1作為Remestemcel生物功能的放行指標,并且在臨床試驗中觀察到了TNFR1表達水平與臨床治療效果的相關性。
干細胞修復損傷、調控免疫,是一個非常復雜的過程。如何在如此復雜的過程中找到標志性物質,提出合理的作用機制模型,并將其MOA與臨床結果形成充分必要條件,是中國干細胞藥企在提交NDA申請(New Drug Application)前必須解決的問題。
虛懷若谷 剖析研判尋找差距
FDA生物制品評估與研究中心(CBER)主任Peter Marks博士表示:“Ryoncil的批準標志著細胞療法在治療危及生命的疾病方面取得了歷史性進展,尤其是面對目前治療選擇有限的兒童患者。Ryoncil的獲批充分體現了FDA致力于支持開發安全有效,并能顯著改善患者生活質量的創新療法。”

這反映了藥監當局對創新藥物的態度,解決未被滿足的臨床需求。我們或許應該在臨床方案的制定上多花些心思,不跟風、不盲從,選擇合適的臨床策略,有效挖掘潛在的臨床獲益或受益人群,最大程度爭取藥監當局的支持。
我國干細胞企業能否借著Mesoblast的東風順勢而上,獲得國家藥品監督管理局的認可,則需要企業多問自己幾個問題,評估自己在工藝穩定性、臨床研究與藥效學研究等方面的差異,計算我們還有多長的路要走?
首先,工藝穩定性方面,是否找到合適的關鍵質量屬性?能否實現干細胞產品的規模化生產?
其次,臨床研究方面,是否制定了合適的臨床策略,是否有合理的臨床設計方案,能否拿到強有力的臨床支持數據?
再次,藥效研究方面,作用機制研究是否經得起推敲?是否找到了合適的藥效學指標,并能在臨床數據中得到證實?
創新引領 推動行業未來發展
作為干細胞制藥領域的杰出代表, 九芝堂美科(北京)細胞技術有限公司(以下簡稱九芝堂美科)在中國干細胞成藥道路上持之以恒,不斷探索,矢志不渝地走在科技創新與品質卓越的最前沿。

九芝堂美科深知,工藝影響療效,影響臨床進度,甚至影響未來的商業模式。九芝堂美科在美國Stemedica公司的干細胞技術基礎上,不斷創新,突破自我,建立了自己的核心競爭力——特殊的低氧培養工藝及國際領先的規模化擴增能力,解決了制約行業發展的關鍵問題。目前,九芝堂美科具備從單一骨髓來源生產1000萬份成品的擴增能力(每份成品為5000萬個細胞),積累了百余批干細胞產品的生產經驗,實現了間充質干細胞產品優異的批間一致性。
藥品質量之于干細胞制藥企業,就如同基石之于大廈,是企業生存與發展的根本。九芝堂美科始終將細胞質量視為企業的生命線,在堅實的工藝基礎上,建立了完善的質量管理體系及標準化的質控方案(鑒別、效力、質量、純度和劑型等)。公司送檢了4個不同供者來源的人骨髓間充質干細胞細胞庫、制劑、原液、高代次產品,共計16種樣品至中國食品藥品檢定研究院進行復核檢驗,檢測結果全部合格。這表明九芝堂美科的“人骨髓間充質干細胞”產品在基本生物學屬性、微生物學安全性、生物學安全性、生物學有效性方面已達到國家要求的臨床應用標準。
九芝堂美科充分發揮先鋒企業的引領作用,基于核心的干細胞新藥工藝開發能力、規模化生產能力與質控檢測服務能力,搭建干細胞CQDMO(Contract Quality, Development and Manufacturing Organization,CQDMO)服務平臺,為產業相關企業和科研機構提供CQDMO一站式全流程服務,包括干細胞建庫、工藝開發、方法學開發與確認、注冊申報等,滿足干細胞相關企業從早期研發、研究者發起的臨床試驗((Investigator Initiated Trials, IIT ),到新藥臨床試驗(Investigational New Drug,IND)、商業化生產的要求,更加高效地推進干細胞新藥的研發進展與上市進程。
“萬丈高樓平地起,一磚一瓦皆根基”,藥品生產不能投機取巧,更不能閉門造車。九芝堂美科希望借助其CQDMO服務平臺,不僅為干細胞企業提供滿足中美申報要求的GMP廠地、專業的人員團隊及完善的質量管理體系,更基于自身經驗提供專業的指導,如生產策略的制定、質控方法學的開發與注冊申報資料的準備等,與行業同仁攜手共進、合作共贏,共同推動我國干細胞行業的發展和進步。

















