衛材在2022ESMO上公布海樂衛的事后分析結果
分析評價了艾立布林在三項臨床研究中對轉移性HER2低表達乳腺癌的療效
衛材株式會社(總部:東京,首席執行官:內藤晴夫,“衛材”)公布了三項隨機、關鍵性III期研究(EMBRACE試驗/研究305、研究301和研究304)的事后分析結果,這三項研究旨在評價甲磺酸艾立布林(HALAVEN?,中文名:海樂衛?)與其它化療(分別為醫生選擇的化療藥物[TPC]、卡培他濱和長春瑞濱)相比治療HER2低表達或無HER2表達的轉移性乳腺癌(mBC)患者的療效。這些數據已于2022年9月9日至13日在法國巴黎舉行的歐洲腫瘤內科學會(ESMO)年會(#ESMO22,線上線下結合)上以海報的形式呈現(報告:#259P)。
HER2低表達乳腺癌亞型是一種新定義的癌癥類型,包括既往根據免疫組化(IHC)測定和原位雜交(ISH)測定結果評估為HER2陰性的腫瘤。HER2低表達腫瘤的HER2蛋白表達水平較低,但并不足夠被認為是HER2陽性。HER2低表達定義為IHC評分為1+或2,且ISH評分為陰性。預計2022年美國約有28.8萬新增女性乳腺癌確診病例1。據估計,約有80-85%的患者以前被視為HER2陰性亞型患者,而其中約60%的患者現在將被視為HER2低表達亞型患者2。
衛材首席科學官兼高級副總裁Takashi Owa博士表示:“在這項事后分析中,HER2低表達mBC患者的結局與三項關鍵性III期臨床試驗的結果一致。隨著腫瘤學界對mBC的認識的不斷深入,繼續評價現有療法在新疾病背景下的作用,以此幫助醫療保健專業人員完善知識體系也變得越來越重要。”
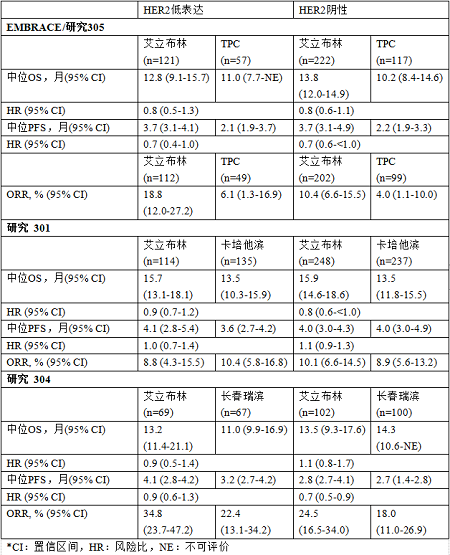
事后分析數據
事后分析包括三項試驗的數據,即艾立布林相較于TPC(NCT00388726,EMBRACE試驗/研究305)、卡培他濱(NCT00337103,研究301)以及長春瑞濱(NCT02225470,研究304)治療既往接受過化療(包括蒽環和紫杉烷類藥物)治療(研究301≤2線;研究304和EMBRACE試驗/研究305為2-5線)的局部復發性或轉移性乳腺癌患者。EMBRACE試驗/研究305、研究301和研究304共入組1589名符合條件的患者,所有研究中各治療組之間的基線特征基本均衡。對中位總生存期(OS)、中位無進展生存期(PFS)和客觀緩解率(ORR)進行了分析。PFS和ORR由獨立影像學審查委員會根據實體瘤療效評價標準(RECIST)(1.0版:EMBRACE試驗/研究305和研究301;1.1版:研究304)進行測量。ORR則在可評價患者(EMBRACE試驗/研究305)和意向治療人群(研究301和研究304)中進行測量。
在事后分析中,HER2低表達或HER2陰性患者的OS、PFS和ORR總體上與EMBRACE試驗/研究305、研究301和研究304中艾立布林治療組的結果相似3,4,5。這三項研究中HER2低表達和HER2陰性患者的療效結果總結見下表: