昭衍講堂丨抗體藥物:從開發(fā)到臨床
抗體融合蛋白(antibody fusion protein)、抗體偶聯(lián)藥物(antibody-drug conjugate,ADC)、雙特異性抗體(bispecific antibody,BsAb)、小分子抗體片段、多特異性抗體、抗體-小干擾RNA(siRNA)偶聯(lián)物(ARC)……,抗體藥物在成為“魔彈”的路上從未停滯。
1975年,Kohler和Milstein成功利用雜交瘤技術(shù)生產(chǎn)了單克隆抗體(monoclonal antibodies,mAbs)。1986年,全球首個鼠源單克隆抗體藥物莫羅莫那單抗(muromonab-CD3)經(jīng)美國食品與藥品監(jiān)督管理局(US Food and Drug Administration,F(xiàn)DA)批準(zhǔn)上市……,抗體藥物歷經(jīng)數(shù)十年的發(fā)展,已經(jīng)成為生物藥中增長最快的領(lǐng)域。
目前,獲FDA批準(zhǔn)上市的抗體藥物已超100個,超80種抗體藥物獲國家藥品監(jiān)督管理局(National Medical Products Administration,NMPA)批準(zhǔn)進(jìn)口,國內(nèi)自主研發(fā)并成功上市的國產(chǎn)抗體藥物近10種。隨著更多抗體藥物的成功上市,適應(yīng)癥覆蓋面也在進(jìn)一步擴(kuò)大,涵蓋腫瘤、炎癥、自身免疫疾病、器官移植排斥、病毒感染等多種疾病。
萬物偶聯(lián)、雙抗爆發(fā) 治療性抗體一直在“內(nèi)卷”
抗體(antibody)又稱免疫球蛋白,是由B淋巴細(xì)胞接受刺激后產(chǎn)生的糖蛋白,結(jié)構(gòu)呈“Y”字型,具有特異性結(jié)合抗原的功能,在人體抵御外界感染性病原體中發(fā)揮重要作用。
早期抗體藥物是鼠源單克隆抗體,存在免疫原性強(qiáng),半衰期短等問題。歷經(jīng)數(shù)十年的發(fā)展,抗體藥物從最初的鼠源單抗,逐步發(fā)展為人鼠嵌合抗體、人源化抗體及全人源化抗體。通過片段重組、位點(diǎn)修飾、藥物偶聯(lián)等方法,科研人員研發(fā)了包括抗體融合蛋白、抗體偶聯(lián)藥物、雙特異性抗體、小分子抗體片段等形式多樣的抗體藥物。
其中,抗體偶聯(lián)藥物(Antibody Drug Conjugate,ADC)是指通過連接子將小分子細(xì)胞毒性藥物偶聯(lián)至靶向特異性抗原的單克隆抗體上的一類生物技術(shù)藥物。其由三部分組成,分別是能夠?qū)Π┘?xì)胞靶向的單克隆抗體、高生物活性的小分子藥物以及能夠?qū)慰购托》肿铀幬镞B接的連接子。
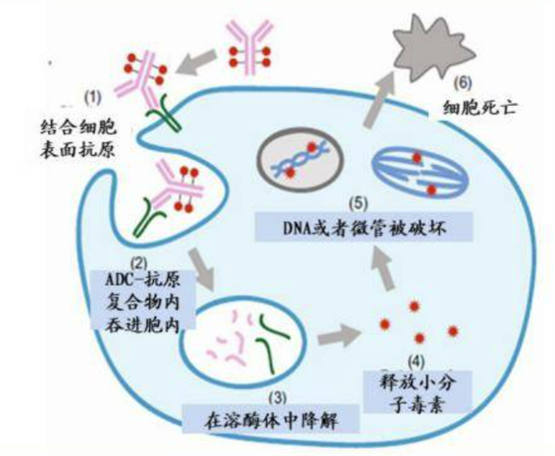
圖片來源于網(wǎng)絡(luò)
當(dāng)前,隨著生物技術(shù)和偶聯(lián)技術(shù)的進(jìn)步,ADC已經(jīng)突破了傳統(tǒng)的抗體+連接子+毒性小分子的模式,多抗偶聯(lián)藥物、核素偶聯(lián)藥物(RDC)、小分子偶聯(lián)藥物(SMDC)、多肽偶聯(lián)藥物(PDC)、雙環(huán)肽偶聯(lián)藥物、抗體免疫刺激偶聯(lián)藥物(ISAC)、抗體細(xì)胞偶聯(lián)物(ACC)、抗體寡核苷酸偶聯(lián)物(AOC)等新型偶聯(lián)藥物出現(xiàn)在大眾視野。
這些新型偶聯(lián)藥物通過發(fā)揮各個偶聯(lián)組分的優(yōu)勢,提高了疾病的治療效果,進(jìn)一步擴(kuò)大了ADC藥物的治療領(lǐng)域,除了在腫瘤靶向治療上發(fā)揮著重大作用,也拓展到了自身免疫疾病等其他適應(yīng)癥上。
與此同時,雙特異性抗體也進(jìn)入爆發(fā)期,將邁向更具臨床效果的高成藥性平臺、聯(lián)合療法、多特異性抗體。
據(jù)Patsnap新藥情報(bào)數(shù)據(jù)庫統(tǒng)計(jì),目前全球有800多款雙抗在研藥物,中國也有400多款在研藥物。從全球來看,進(jìn)入臨床階段的雙特異性抗體藥物280多款,其中3款申請上市,12款處于III期臨床。從國內(nèi)的研發(fā)進(jìn)展來看,進(jìn)入臨床階段的雙特異性抗體藥物接近150款,其中3款申請上市,10款處于III期臨床。
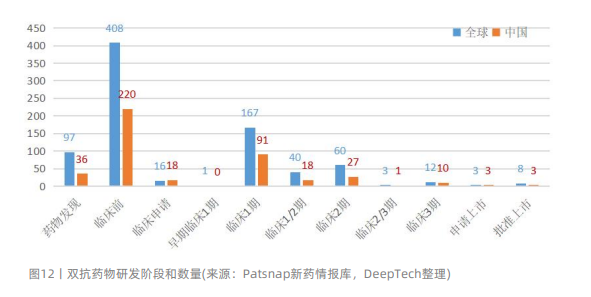
雙特異性抗體藥物技術(shù)獲得了極大的進(jìn)步,多個技術(shù)平臺的開發(fā)解決了不同類型雙抗的缺點(diǎn),如不含F(xiàn)c片段的雙抗(非lgG樣雙抗)的清除速度快、半衰期較短的缺點(diǎn),含F(xiàn)c片段的雙抗(lgG樣雙抗)的重輕鏈錯配問題等。
此外,抗體類型也不限于雙特異性抗體藥物,已有三特異性抗體(Tri-specific Antibody)、四特異性抗體(Tetra-specific Antibody)等同時靶向多種抗原表位的多特異性抗體(Multi-specific Antibody)藥物進(jìn)入臨床研發(fā)階段。
研發(fā)成本高、成功率低 治療性抗體可開發(fā)性評估成為重點(diǎn)
抗體藥物研發(fā)生產(chǎn)技術(shù)逐漸成熟與完善,其在生物治療藥物的市場上占據(jù)重要地位,但同時其也存在新靶點(diǎn)難以開發(fā)、研發(fā)成本高、成功率低、臨床研究進(jìn)展緩慢、缺乏規(guī)范的標(biāo)準(zhǔn)等問題與挑戰(zhàn)。
具體來看,目前主要以人源化抗體研發(fā)技術(shù)較成熟且成功上市產(chǎn)品占比較大,而以人血漿來源的抗體藥物成分復(fù)雜,來源稀少,不能滿足巨大的市場需求,且存在倫理問題和潛在的危險性,而來源于動物的抗體藥物免疫原性較強(qiáng),容易引起過敏反應(yīng),并且病毒及腫瘤的位點(diǎn)突變造成的逃逸,還會導(dǎo)致單位點(diǎn)抗體藥物失效。
安全性、有效性等多種原因致使抗體藥物的研發(fā)成本居高不下、成功率微乎其微。據(jù)了解,一個抗體藥從臨床前到批準(zhǔn),開發(fā)費(fèi)用超過10億美元。目前全球正在進(jìn)行I、II期臨床試驗(yàn)的抗體藥物超過550種,另有79種已經(jīng)進(jìn)入開發(fā)的最后階段。但是,即便是人源或人源化抗體,即便已進(jìn)入到臨床試驗(yàn)階段,最終能夠成功開發(fā)上市的只有15%左右。
有文獻(xiàn)顯示,為了降低后期研發(fā)失敗的風(fēng)險與損失,提高成功率,臨床前階段就要對候選抗體進(jìn)行可開發(fā)性評估。廣義上,可開發(fā)性評估包括有效性與安全性、可生產(chǎn)性(manufacturability)、系列理化特性等3個部分。
傳統(tǒng)上,開發(fā)者用于篩選抗體的首要標(biāo)準(zhǔn)是抗體與相應(yīng)抗原的親和力,可用酶聯(lián)免疫吸附、石英晶體微天平、表面等離子體共振、功能測試等實(shí)驗(yàn)進(jìn)行檢測;其次是抗體在動物實(shí)驗(yàn)中的藥效、藥代動力學(xué)特征及安全性。
和生產(chǎn)相關(guān)的影響因素主要包括抗體生產(chǎn)細(xì)胞系穩(wěn)定性、表達(dá)水平、純化回收率、放大生產(chǎn)性能、制劑穩(wěn)定性、生產(chǎn)成本等,是涉及細(xì)胞工程、抗體工程、發(fā)酵工程、藥劑學(xué)等相關(guān)大量實(shí)驗(yàn)技術(shù)的系統(tǒng)工程。
不少新型抗體藥物有效性與安全性挑戰(zhàn)較大,研發(fā)流程尚不成熟,多處于臨床前研究階段,相關(guān)管理規(guī)定尚未出臺,在一定程度上限制了抗體藥物的發(fā)展。而研究機(jī)構(gòu)與企業(yè)聯(lián)動合作,充分發(fā)揮兩者優(yōu)勢,是加速研發(fā)有效抗體藥物的重要方式。
抗體藥物評價超360個 昭衍新藥多平臺助力其研發(fā)上市
作為中國最早從事藥物非臨床評價的民營CRO企業(yè),昭衍新藥具有符合國際規(guī)范的質(zhì)量管理體系(CNAS/ILAC-MRA認(rèn)證),具備中國NMPA、美國FDA、經(jīng)合組織OECD、韓國MFDS、日本PMDA的GLP資質(zhì)以及國際AAALAC和OLAW(動物福利)認(rèn)證資質(zhì),評價資料滿足全球藥品注冊要求。可以向客戶提供CDMO、藥理藥效學(xué)研究、生物分析(DMPK)、藥物安全性評價研究、臨床檢測等一站式服務(wù)。
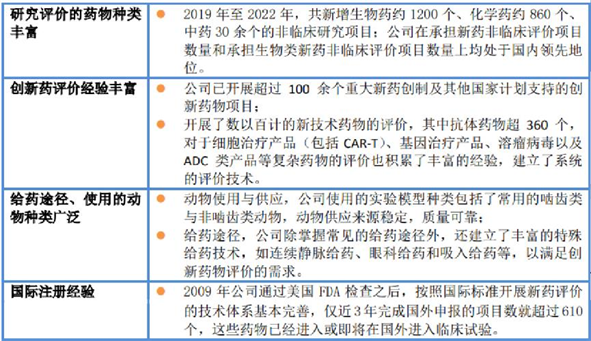
圖片來源:昭衍新藥2022年度報(bào)告
在抗體的非臨床評價方面,昭衍新藥評價了中國首個獲國家藥監(jiān)局批準(zhǔn)上市的ADC藥物、首個獲批用于臨床研究的雙特異性抗體等。截止2022年,已評價的抗體藥物超過360個。昭衍新藥針對不同類型的創(chuàng)新抗體產(chǎn)品,提供個性化的設(shè)計(jì)方案,從藥理藥效、生物分析方法開發(fā)、藥代動力學(xué)、毒理學(xué)評價等方面,不斷探索和實(shí)踐,為新型抗體產(chǎn)品提供全面的高質(zhì)量的非臨床評價服務(wù)。
在CDMO方面,2018年成立北京昭衍生物技術(shù)有限公司(簡稱:“昭衍生物”),將以中美兩地研發(fā)生產(chǎn)基地為依托,為全球創(chuàng)新藥研發(fā)機(jī)構(gòu)提供可開發(fā)性研究、工藝放大優(yōu)化、質(zhì)量研究、中試及商業(yè)化生產(chǎn)一站式解決方案,是業(yè)內(nèi)唯一能給客戶提供“中美兩地雙廠生產(chǎn)”的服務(wù)模式。
昭衍還設(shè)有“昭衍藥檢”,主要面向蛋白藥物、疫苗、基因與細(xì)胞治療產(chǎn)品等創(chuàng)新藥物質(zhì)量研究與檢定的第三方檢測機(jī)構(gòu),為社會提供創(chuàng)新藥物質(zhì)量標(biāo)準(zhǔn)研究,檢定方法建立,標(biāo)準(zhǔn)物質(zhì)制備及鑒定,細(xì)胞庫、菌毒種庫、原液、成品檢驗(yàn)檢測,生產(chǎn)工藝質(zhì)量控制關(guān)鍵步驟如病毒滅活與清除驗(yàn)證等相關(guān)服務(wù),致力于支持和促進(jìn)創(chuàng)新藥物的研發(fā)及產(chǎn)業(yè)化進(jìn)程。
而為了國內(nèi)及全球范圍內(nèi)的創(chuàng)新藥物品種提供一站式的臨床試驗(yàn)樣本檢測服務(wù),“昭衍臨床檢測”,具備完善的符合國內(nèi)和國際GLP、GCP、GCLP,以及CNAS 17025等的質(zhì)量管理體系,擁有北京、蘇州、美國波士頓三處臨床分析實(shí)驗(yàn)室,專注于大分子藥物,特別是抗體藥物,基因及細(xì)胞治療藥物、小分子藥物、生物標(biāo)志物的臨床檢測。
當(dāng)前治療性抗體領(lǐng)域仍充滿挑戰(zhàn)與荊棘,作為服務(wù)藥物創(chuàng)新首屈一指的CRO/CDMO公司,昭衍正在不斷地增強(qiáng)自身優(yōu)勢、提高技術(shù)壁壘、擴(kuò)大產(chǎn)能建設(shè)、多維度布局科技創(chuàng)新,助力抗體藥物的快速研發(fā)。
為此,昭衍將分別于2023年5月23日、6月6日、6月20日,晚上19:00-20:30,三期6位老師,系統(tǒng)性的向大家分享新型抗體藥物的前沿進(jìn)展及技術(shù)壁壘,共同探討該領(lǐng)域火熱賽道下,新型抗體藥物質(zhì)量研究策略、非臨床評價策略、藥代動力學(xué)特征、臨床檢測策略等方面內(nèi)容,歡迎從事本領(lǐng)域的專家學(xué)者一同參與討論!
















